 醫學研究部(Department
of Medical Research)
醫學研究部(Department
of Medical Research)共 同 研 究 室 電 子 報
第九十九期 MAR.10.2022
本期目錄
下期主題
快速連結
由於國家支持生醫產業發展,細胞治療已成近年來當紅產業,從我國頻繁修訂細胞治療相關法令可見政府相當重視,該產業若要永續蓬勃發展,除了新技術開發外,仍須有良好制度把關細胞治療產品品質,此重要一環需本院執行同仁努力維持,本期電子報非常榮幸能邀請醫學研究部細胞治療中心共同執筆,為研究同仁介紹本院如何管控細胞治療產品品質及說明細胞治療技術申請流程,讓同仁能清楚瞭解到如何安全推廣細胞治療技術,使研究成果更上層樓。下一期電子報主題為「外泌體純化:聚合物沉澱法原理介紹」,敬請期待,並竭誠歡迎您訂閱共同研究室電子報以收取儀器介紹、研究新知、與每月訓練課程資訊,更歡迎您與我們聯絡,給予我們建議與鼓勵。
[模式動物系列講座公告]
TOP
醫學研究部細胞治療中心
細胞治療法源依據
依據「醫療法」(第62條)、「人體試驗管理辦法」、「人體細胞組織優良操作規範」(GTP)、「體細胞/基因治療人體試驗申請與操作規範」,可執行細胞治療相關臨床試驗,另訂訂「特定醫療技術檢查檢驗醫療儀器施行或使用管理辦法」(民國110年修訂)提供特定疾病病友自費執行細胞療法,若以上市為目的則另外依循藥事法中藥品查驗登記審查準則及藥物優良製造準則(GMP)規範,另衛生福利部已於111年01月13日公告「再生醫療發展法」草案及「再生醫療施行管理條例」草案,有望於今年完成修法。
本院細胞治療管理現況
2016年3月1日本院細胞治療管理小組成立,旨為建立本院細胞治療發展平台(細胞治療中心),並協助協調本院細胞治療案件,由於本院細胞治療案由原先的一年兩件增至一年十多件,其多數案件皆非本院廠房製備執行,為提升細胞治療研究發展及臨床細胞治療安全性,並配合院方細胞治療發展政策,故於2021年07月23日轉型成立院層級細胞治療委員會,並由原先細胞治療核備制度改為實質審查,可具體提供改進建議,增加本院細胞治療案之安全性。
細胞治療臨床試驗計畫申請跟其他試驗案一樣嗎?
細胞治療臨床試驗案為新興的特殊療法,衛生福利部把關較為嚴謹其流程也較為繁複,細胞治療中心設有諮詢窗口提供送件流程協助,您於送件前可來電約訂諮詢會議(可接受視訊會議)或電郵諮詢。當您完成本院臨床試驗案送件資料後,先行至研究倫理委員會申請暨審查管理系統(PTMS/e-REC)申請本院臨床試驗審查,於此同時可送本院細胞治療案送件申請,本中心將立即安排與細胞製 備場所面談並排入細胞治療管理委員會審查,然面談內容僅提供計畫精進之建議,並不作為審查結果之依據,另管理委員會審查內容將提供給IRB作為審查之依據。

(https://redcap.ntuh.gov.tw/surveys/?s=8K4LJTKRNH)
細胞治療案件(特管法)如何申請?
特管辦法管理模式是介於醫療常規和人體試驗中間,於法令上不需取得人體試驗委員會(IRB)核准,醫師要經過特別訓練,要事前申報計畫書,不良反應時要通報,以及資料要在病歷以外另外紀錄等,都和人體試驗相同;但由於本院自我要求,仍需排入IRB審查,且須有人體試驗作為基礎,故強制要求計畫案須提供同製造廠域第一期臨床試驗成果並檢附結案報告作為依據。
其本院審查流程基本類似於臨床試驗,另額外取得科部會議推薦,癌症類別需取得癌症多專科診療團隊同意,再填寫線上細胞治療案送件申請及紙本細胞治療案件(特管法)審查申請表,然院外合作案訂定合約皆採用勞務採購合約且須經本院醫療費用評定委員會,詳細流程如下圖:
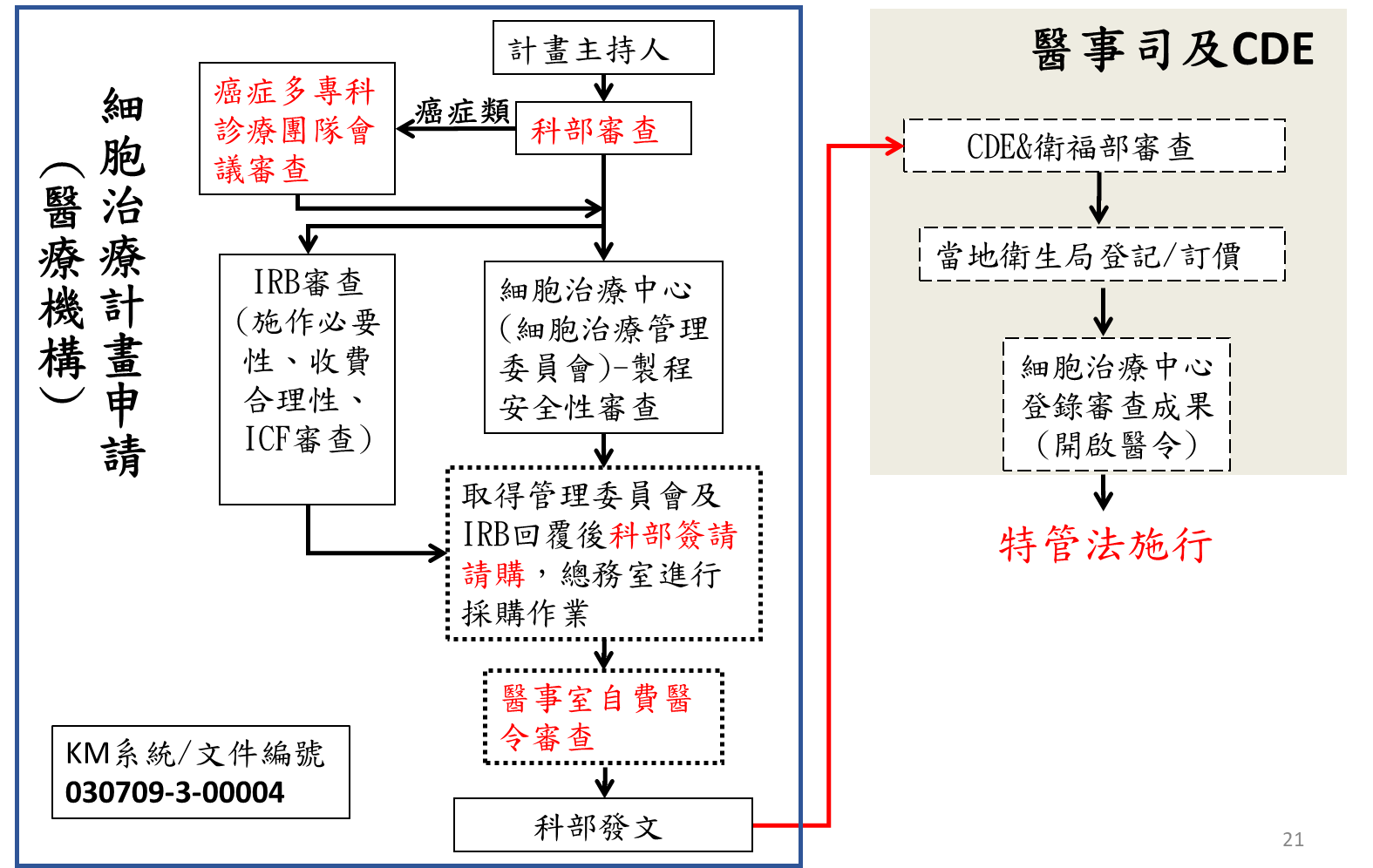
細胞治療執行團隊需要注意什麼?

1.安全性與風險
於1999年來自美國亞利桑那州18歲的基爾辛格(Jesse Gelsinger)在賓州大學接受基因療法人體試驗多重器官衰竭死亡後,其細胞治療安全性與療效備受討論,故臨床前動物試驗相當重要,並依科學證據訂定安全治療劑量:另現今熱門誘導性多功能幹細胞(iPS細胞)可分化為T細胞治療癌症,亦可分化為胰島細胞治療糖尿病;再生醫學上,心肌梗塞、中風等這類因故導致心肌細胞或神經細胞死掉並失去功能的部分,都能用多能幹細胞iPS變成需要的細胞,但須注意殘存未能完全分化的iPS細胞也有癌化的問題,此等安全性議題不容小覷。急性淋巴性白血病病人接受CAR-T細胞治療都有發生所謂的細胞激素釋放症候群(cytokine release syndrome),當注射到病人的CD19 specific CAR-T細胞和CD19 positive的血癌細胞結合,會引發T細胞的活化和大量增生並釋出細胞激素,造成症狀如高燒、低血壓、腎衰竭、白血球低下、凝血功能異常、呼吸衰竭等副作用,其主治醫師應徹底了解相關副作用,並接受相關教育訓練,可妥善處理病人任何不良反應。
作為特管法的發起者應逐字看過廠商提供之施行計畫,確實了解細胞從何而來,其安全性為何?了解與這間廠商合作會有什麼風險嗎?再者特管法施行醫師應共同規範細胞產品到醫院後存放處,制定符合規範運輸程序及回輸標準,以確保回輸細胞之安全性。
2.療效與醫療費用
特管法介於未滿常規醫療且臨床試驗未完成的階段,對許多病人及家屬而言,是用盡常規醫療行為的最後機會,故有許多病人願意花大錢換取生命的一線希望,但特管法療效未確定,且為全自費的高價醫療行為,極有可能會造成健康不平等議題。本院近年來頻頻接受詢問,希望在本院優質醫療服務下取得特管法相關細胞治療,故本院才會採取嚴格程序把關合作之廠商,因此作為特管法施行醫師應共同戮力維持此醫療品質,於施行細胞治療技術前該向病人說明已知效果、風險、可能之不良反應、救濟措施、有效治療的定義以及費用的收取及其他必要事項,進而與廠商了解細胞無法製成適合回輸之細胞治療產品及病人因疾病的變化或個人因素而無法完成療程時,費用該如何收取?將各種可預期發生情況告知病患,畢竟病患信任的是本院醫師,並非是某廠商或產品,別讓自己的疏忽替廠商背鍋。
3.倫理議題
首先議題要了解自己研究(施行)細胞為何,該細胞是否有倫理性之疑慮,例如胚胎幹細胞之研究應遵守人類胚胎及胚胎幹細胞研究倫理政策指引 (2007年8月9日),再者應取得病患及其家屬之知情同意(EX:病人須簽屬細胞治療技術同意書及細胞治療說明書),並於以下三個時機重新簽屬知情同意。
-
簽署後三個月內未施行時
-
發現建議技術項目有所變更時
-
有再度為病人施行技術之必要時
最後細胞治療技術中,剩餘檢體是否可做其他人體研究是個應該被重視的問題。應避免在細胞治療技術中夾帶人體研究,也禁止轉作商業用途收取後續費用,特管法是由病人付費所進行的自費治療,按民法物權的觀念,其委託產出物與衍生之產品均屬病人所有,故一切產出都應歸屬病人,不可以細胞治療技術同意書夾帶無償剩餘檢體挪為研究用字句,易造成後續爭議。
標準作業程序書(SOP)撰寫與輔導
目前細胞治療中心已撰寫出一套因應本處理場所使用的SOP,並請資訊室撰寫搭配SOP之物料及試劑管理軟體,可配合各計畫的計畫書、受試者同意書及病歷報告書,撰寫出符合GTP法規之作業程序書,此作業程序書為GTP訪查之重點;且本中心可協助計畫書修改諮詢及提供計畫所需模擬驗證,若有其他臨床(前)試驗問題需協助,皆可連絡中心范邁儀博士(分機:62963),若有儀器預約及諮詢可連絡中心李昇憲先生或陳玟均小姐(分機:67834 & 67833 )。
相關文件下載
1.院內特管法細胞治療案申請作業及管理要點
(1)特管法細胞治療案申請作業及管理要點- KM系統/文件編號 030709-3-00004
2.衛福部醫事司申請細胞治療技術之相關須知事項
(1)細胞治療技術特管法修正條文- 衛生福利部醫事司/生醫科技及器官捐贈/細胞治療技術
(2)申請施行細胞治療技術須知- 衛生福利部醫事司/生醫科技及器官捐贈/細胞治療技術/申請細胞治療技術之相關須知事項
(3)細胞製備場所GTP認可申請注意事項- 衛生福利部醫事司/生醫科技及器官捐贈/細胞治療技術/申請細胞治療技術之相關須知事項
(4)細胞治療技術申請計畫書(格式)- 衛生福利部醫事司/生醫科技及器官捐贈/細胞治療技術/申請細胞治療技術之相關須知事項
儀器訓練課程:課程網路報名
|
03月16日 |
IPA生物分子路徑分析軟體服務介紹 |
|
03月21日 |
多色即時聚合酶連鎖反應系統(CFX 96 Real-Time PCR System) |
歡迎您訂閱共同研究室電子報以收取儀器訓練與研究新知課程講習相關資訊 。
為持續提供優質之研究服務,便於日後聘用專職技術人員、購置新儀器、現有儀器汰舊換新與維護保養等等,敬請於使用共同研究室資源並發表論文時,於論文致謝(Acknowledgement)處加入致謝共同研究室之文句,並於論文發表時通知共同研究室管理人員。致謝文句請依實際使用情形書寫,或請參考以下範例:We
thank the staff of the Core Labs, Department of
Medical Research, National
Taiwan University Hospital for
technical support.