 醫學研究部(Department
of Medical Research)
醫學研究部(Department
of Medical Research)共 同 研 究 室 電 子 報
第七十六期 APR.10.2020
本期目錄
下期主題
快速連結
近年來,細胞螢光影像已相當成熟,將細胞固定並標記螢光分子,透過光學顯微鏡獲取清晰影像來闡述不同的生物機制。然而,終點反應的影像並無法完整地呈現細胞時程變化。因此,活細胞動態影像成為研究者新的需求及趨勢。本期電子報將介紹新的螢光標定技術如何協助研究者解決活細胞動態影像的困境及如何呈現細胞原貌,祈能提供更方便有效的工具協助研究人員在細胞生物學領域取得突破的發現與研究。下一期電子報主題為「斷層掃描細胞分析儀 (NanoLive image)介紹 」,敬請期待,並竭誠歡迎您訂閱共同研究室電子報以收取儀器介紹、研究新知、與每月訓練課程資訊,更歡迎您與我們聯絡,給予我們建議與鼓勵。
TOP
萊富生命科技公司林羿帆 產品經理
顯微鏡是細胞生物學研究不可或缺的工具,隨著研究者欲深入地瞭解細胞機制,僅僅觀察細胞型態已經不足以應付細胞生物學研究的需求,如何標定細胞內不同分子或胞器成為研究細胞機制迫切的需求。此時,不同的螢光標定技術應運而生。化學家和生物學家藉由不同化學分子或蛋白質的特性,開發出具備螢光訊號的化學染劑或螢光蛋白,藉此研究者可以直接地觀察有興趣之分子或胞器的數量及型態,為螢光細胞影像開啟了新的篇章。近年來,細胞螢光影像已相當成熟,將細胞固定並標記螢光分子,透過光學顯微鏡獲取清晰影像來闡述不同的生物機制。然而,終點反應的影像並無法完整地呈現細胞時程變化。因此,活細胞動態影像成為研究者新的需求及趨勢。本期電子報將介紹新的螢光標定技術如何協助研究者解決活細胞動態影像的困境及如何呈現細胞原貌。目前研究者於活細胞動態影像常見的困境包含:維持健康細胞及生長環境、活細胞螢光標定染劑的選擇、長時間拍攝之光照影響。
維持健康細胞及生長環境
進行細胞動態影像實驗第一要件為合適的環境維持細胞健康狀態及形態,建立細胞培養環境的需求包含溫度、滲透壓、酸鹼值、濕度等。這些需求的必要性會根據不同研究目的而有所不同。例如觀察細胞內鈣離子累積或觀察細胞生長,兩者所需的反應時間不同,因此需要的培養環境要求也不盡相同。在鈣離子累積反應實驗,其觀察時間通常介於數分鐘至數十分鐘,且常常搭配注射器進行動態影像擷取,因此並不適合使用密閉式的細胞培養裝置來維持環境之濕度及二氧化碳。這類的實驗通常利用增加培養溶液體積或使用特殊培養溶液來穩定滲透壓及酸鹼值。
活細胞影像溶液(Live Cell Imaging Solution, LCIS)含有羥乙基哌嗪乙硫磺酸((4-(2-hydroxyethyl)-1-piperazineethanesulfonic acid), HEPES),是一種兩性離子型生物緩衝液,可將溶液維持在pH 7.4酸鹼值。Live Cell Imaging Solution可以做為細胞染色或染劑清洗之溶液,使用Live Cell Imaging Solution進行活細胞動態影像實驗可維持細胞健康長達四小時(圖一)。Live Cell Imaging Solution除了可以增加細胞存活率之外,還能為螢光影像提供更佳的清晰度(Clarity)及信噪比(Signal-to-noise ratio)。
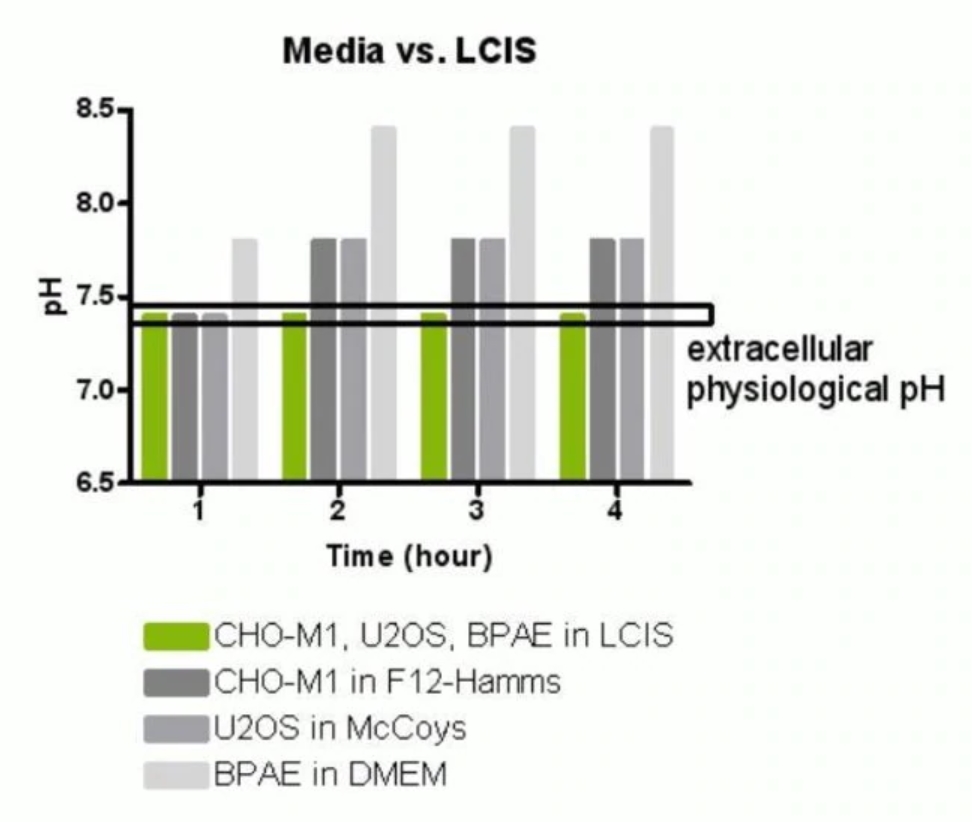
圖一、觀察Live Cell Imaging Solution及一般細胞培養溶液於四小時內,環境pH值的變化。四種溶液中僅Live Cell Imaging Solution能穩定維持四小時溶液的pH值。
在觀察細胞生長實驗,其觀察時間通常耗費數天,因此必須使用具備溫度、濕度及二氧化碳控制的專用培養箱來提供細胞健康生長所需的環境。除此之外,細胞培養溶液也會影響細胞動態影像之背景及雜訊。FluoroBrite™ DMEM (Dulbecco's Modified Eagle Medium)是一種不含酚红(Phenol Red)的細胞培養溶液。一般細胞培養時使用的DMEM培養基需添加Phenol Red來觀察溶液的pH值,但Phenol Red本身的螢光光譜在拍攝螢光影像時會造成背景訊號增加。FluoroBrite™ DMEM細胞培養溶液因不添加Phenol Red,不但可以長時間維持細胞健康生長,亦可比一般DMEM細胞培養溶液降低約90%的背景訊號(如圖二)。有助於研究者得到更清晰的細胞影像,也能降低曝光強度及曝光時間,減少因光源照射引起的光毒性(Phototoxicity)及光漂白(Photobleaching)效應。

圖二、FluoroBrite™ DMEM和DMEM於背景訊號之比較。FluoroBrite™ DMEM明顯降低約90% 的背景螢光訊號,提高了接近9倍的信噪比。
細胞螢光標定染劑的選擇
螢光標定技術主要有四種方式:螢光抗體標記、螢光蛋白標記、化學分子染劑、螢光奈米粒子。其中螢光抗體標記是藉由一級抗體的多元性及帶有螢光之二級抗體結合,為生物學研究提供各種分子標記的便利性。然而為了維持細胞健康並觀察細胞動態變化,活細胞在螢光標定技術上存在許多限制及困境。隨著新技術的發展,新的螢光標定技術提供研究者更多的選擇來進行活細胞染色。在細胞生物學研究中,研究者常利用活細胞動態影像來研究生物機制,接下來分別介紹新的螢光標定技術如何應用在細胞形態及細胞原貌的觀察:
1.Tubulin Tracker™ Deep Red
微管蛋白(Tubulin)是構成細胞骨架(Cytoskeleton)的主要分子之一,螢光標記Tubulin不但能呈現Cytoskeleton及細胞形態,同時也能觀察細胞胞器運輸、細胞分裂、細胞移動及訊號傳遞,藉此了解細胞從健康到死亡之間的變化。螢光抗體及螢光蛋白是標記Tubulin常用的技術,然而螢光抗體無法應用在活細胞觀察,螢光蛋白則在質體建構(Plasmid construction)及蛋白表現效率都有其限制。Tubulin Tracker™ Deep Red是一種新的Tubulin標記試劑,其原理是利用一種化療藥物Docetaxel具有結合Tubulin的特性,將Docetaxel分子鍵結上螢光分子,藉此標記細胞內Tubulin。Tubulin Tracker™ Deep Red具備自由通透細胞膜的能力及深紅光較低光毒性的特性,因此比較適合用在活細胞動態影像觀察(圖三),例如細胞增生(Cell proliferation)、有絲分裂(Mitosis)、神經突生長(Neurite Outgrowth)等研究。
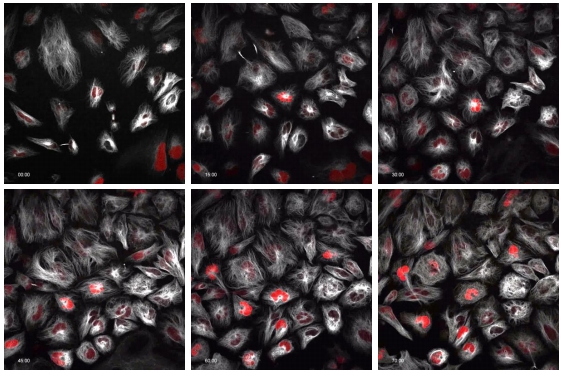
圖三、使用Tubulin Tracker™ Deep Red標記HeLa cells,每20min擷取影像,活細胞持續觀察72hrs。圖左分別為0, 15, 30,45,60,70 hr影像。
2.Premo™ FUCCI Cell Cycle Sensor
細胞週期(Cell cycle)調控與細胞健康或生物功能息息相關,包含腫瘤生物學研究、藥物開發、胚胎發育學等。因此觀察細胞週期變化是常見的實驗,目前主要的技術包含利用流式細胞儀分析核酸含量及螢光抗體標記細胞週期相關調控蛋白,但這兩種方法並不方便應用在活細胞動態影像實驗。Premo™ FUCCI Cell Cycle Sensor是以一種以螢光蛋白為基礎,利用兩種不同的細胞週期調控蛋白Cdt1及Geminin其在正常細胞週期合成及分解的特性,搭配螢光訊號來反映細胞處於哪一個細胞週期。藉由這樣的原理,當細胞處於G1/S時期,Cdt1-RFP蛋白表現量增加,細胞會呈現紅色螢光;反之,細胞處於G2/M時期,Geminin-GFP蛋白表現量增加,細胞則呈現綠色螢光。因此,Premo™ FUCCI Cell Cycle Sensor應用於活細胞動態影像時,可藉由兩個螢光顏色的轉換來同時觀察細胞分裂及細胞週期的變化,直接呈現細胞週期變化的原貌。
3.CellEvent™ Caspase-3/7 Detection Reagent
細胞凋亡(Apoptosis)是胚胎發育過程中一種自主調控細胞死亡的正常機制,同時也在免疫系統的發展及作用扮演重要的角色。細胞凋亡的過程會產生不同的形態及特徵,包含細胞核染色質聚集、細胞皺縮、形成細胞凋亡小體、核酸斷裂及相關調控蛋白的表現或活化等。其中半胱氨酸蛋白酵素 (Cysteine-aspartic proteases, Caspase)是一系列的蛋白酵素,Caspase的活化反應不但參與細胞凋亡的過程,其中又以Caspase-3/7的活化作為調控細胞凋亡反應的關鍵步驟。因此Caspase-3/7的活化常被用來評估細胞是否凋亡的重要指標,而在這樣的實驗中以西方墨點法(Western blot)最被廣泛使用。CellEvent™ Caspase-3/7 Detection Reagent是一種新的螢光標記技術,利用Caspase-3/7具備辨認及切割DEVD四個胺基酸序列的專一性,將DEVD胺基酸片段鍵結一個核酸螢光染劑。此螢光染劑在DEVD胺基酸片段被切割後才會發出螢光,並且聚集於細胞核內形成明亮的螢光訊號。利用這樣的原理,CellEvent™ Caspase-3/7受質不但可自由通透細胞膜且提供較佳的信噪比,因此不需經過清洗(Wash)及瓦解(Lysis)細胞的步驟,可用於活細胞動態影像中,在顯微鏡下直接觀察每一顆細胞從健康到凋亡的過程及形態。
長時間拍攝之光照影響
連續及過度的光照會導致Phototoxicity及Photobleaching效應,是活細胞動態影像的一大困擾。Phototoxicity會導致非預期的細胞死亡;而Photobleaching則影響標的物觀察或影像清晰度。改善Phototoxicity及Photobleaching效應有以下幾種方式:
1.調整光學顯微鏡拍照設定
為了降低Phototoxicity,進行螢光訊號擷取時,應在可接受範圍內,降低光源強度、減少曝光時間及增加相機靈敏度,藉此減少細胞受到的光刺激,進而降低細胞因過度光照造成的細胞死亡。另外進行拍照前,可事先了解使用染劑的激發光譜(Excitation spectrum)及發散光譜(Emission spectrum),並選用最適合的激發及發散濾片。最佳的染劑與濾片搭配能增加染劑光學效益,並能提高訊號及雜訊比值,因此降低光源強度或曝光時間即能得到足夠的螢光訊號。光學顯微鏡可搭配各式光源,目前常見的光源有金屬鹵素燈、雷射光源及發光二極體(Light-emitting diode, LED)。金屬鹵素燈及雷射光源雖然有較強的能量,但也因此具較強的Phototoxicity。新式的LED光源能量較溫而且具備任意調整燈源強度的彈性,因此可減少過強光照引起的細胞死亡,更適合應用在長時間活細胞動態影像實驗。進行活細胞動態拍攝時,不論是手動對焦或是自動對焦,無形中都是增加細胞接受到更多的光刺激。因此在顯微鏡設定上應盡可能減少對焦次數及時間,甚至可以利用低倍率鏡頭具有較厚的光學視野深度特性(Depth of Field),減少對焦不準確的狀況。或者可依所需反應時間的長短,設定不同時間間隔只拍攝所需之時間點影像,減少對焦及拍攝的次數來改善Phototoxicity及Photobleaching效應,達到長時間活細胞觀察目的。
2.挑選螢光染劑波段
除了調整顯微鏡設定之外,選擇不同螢光染劑波段也有助於改善Phototoxicity及Photobleaching效應。一般來說,較長波長的激發光源有助於降低Phototoxicity及Photobleaching效應,藍光相較於紅光或遠紅光具較強的能量,因此造成較明顯的Phototoxicity及Photobleaching。然而部分感光元件在遠紅外光的量子效益(Quantum efficiency)不佳,因此遠紅外光染劑呈現的訊號較弱,不易進行螢光影像的觀察及判讀。因此,在進行活細胞動態影像時,選擇紅光或深紅光染劑比較能維持螢光影像品質及減少光刺激造成的細胞毒性(圖四),進而有助於觀察細胞反應的真實樣貌。
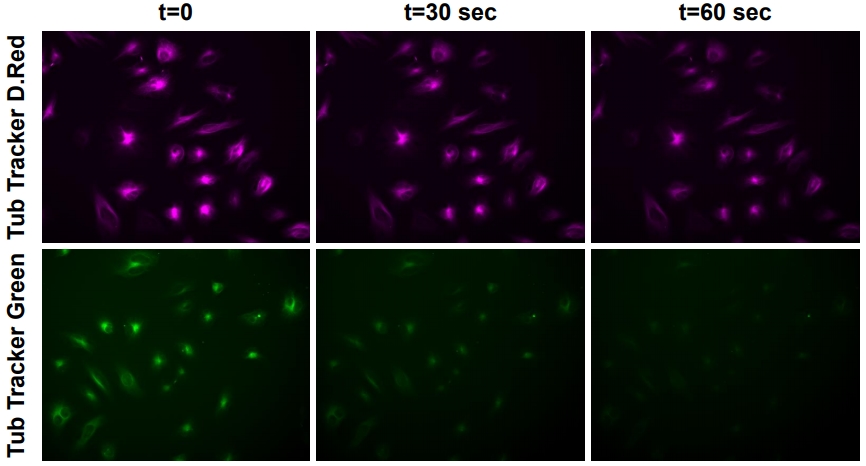
圖四、HeLa cells分別使用Tubulin Tracker™ Deep Red及Green染色,持續曝光及擷取影像。Deep Red展現較好的光穩定性(Photostability)
3.改善螢光衰退現象
造成Photobleaching的主要機制是當染劑受到光源的激發時,通常會被分解並產生一些單態氧自由基(Singlet oxygen, 1O2),這些Singlet oxygen會進一步影響並破壞其他的染劑分子,造成Photobleaching現象。除了上述從實驗方法做調整之外,藉由代謝Singlet oxygen也能改善Photobleaching現象。ProLong® Live Antifade Reagent含有能代謝Singlet oxygen的酵素,藉此維持螢光染劑亮度及降低背景訊號,並且不影響細胞存活、細胞增生及其他細胞正常功能。因此可添加於細胞培養溶液中,幫助活細胞螢光標記物的長時間動態觀察。
總結來說,好的活細胞動態實驗設計提供研究者更清晰明確的影像證據,呈現細胞變化的真實樣貌,並且有助於觀察兩個以上分子或細胞在不同時間點的直接關係。藉由新的螢光標記技術的發展,改善了進行活細胞動態影像面對的限制與困境,新的技術提供更方便有效的工具協助科學家在細胞生物學領域取得突破的發現與研究。
儀器訓練課程:課程網路報名
| 四月份課程因疫情關係暫停辦理,如有特殊需求請逕洽各共研管理人員或技術人員。 |
歡迎您訂閱共同研究室電子報以收取儀器訓練與研究新知課程講習相關資訊 。
為持續提供優質之研究服務,便於日後聘用專職技術人員、購置新儀器、現有儀器汰舊換新與維護保養等等,敬請於使用共同研究室資源並發表論文時,於論文致謝(Acknowledgement)處加入致謝共同研究室之文句,並於論文發表時通知共同研究室管理人員。致謝文句請依實際使用情形書寫,或請參考以下範例:We
thank the staff of the Core Labs, Department of Medical Research, National
Taiwan University Hospital for technical support.