 醫學研究部(Department
of Medical Research)
醫學研究部(Department
of Medical Research)共 同 研 究 室 電 子 報
第六十三期 MAR.10.2019
本期目錄
下期主題
快速連結
近年來細胞治療產業的發展蓬勃興盛,該產業中細胞治療產品的品管檢測極為重要,而內毒素檢測又為細胞治療產品放行回植人體時的重要檢測項目,因此本期電子報將介紹內毒素與其檢測方法。下一期電子報將介紹「全景組織細胞分析儀」,敬請期待,並竭誠歡迎您訂閱共同研究室電子報以收取儀器介紹、研究新知、與每月訓練課程資訊,更歡迎您與我們聯絡,給予我們建議與鼓勵。
TOP
創醫生技-胡恩樺 先生
前言
內毒素為一疏水性小分子,乃組成格蘭氏陰性菌外膜脂多醣複合體的一部分;當細菌死亡時外膜跟著裂解,於是釋出脂多醣片段,在人體內啟動內毒素的致毒機制。為確保使用者安全,不僅醫療器材或注射劑的終產品必須進行內毒素檢測,參與製程的各項製造原料亦在受檢之列。
誠如美國藥典、歐洲藥典及日本藥典所述,無菌檢測可以檢出活的微生物,包含格蘭氏陰性菌;然而在滅菌過程中被殺死的格蘭氏陰性菌所釋出之內毒素,卻無法被無菌檢測檢出。因此對於過度依賴無菌檢測而忽略內毒素存在的製造商而言,其產品毫無疑問地存在著未受管控的致命風險。
當使用者所用的產品含有未檢出的內毒素時,輕微者損害健康,嚴重者則可能危及性命。細菌或內毒素進入血液時,首先引起發炎反應,此時免疫細胞會產生細胞激素,例如介白素I及腫瘤壞死因子,並誘導嗜中性球往感染處移動,透過吞噬作用清除引起這一連串免疫反應有關的微生物和蛋白質。在人體免疫系統處於脆弱狀態或遭遇重度感染時,內毒素進入人體則有引發敗血症及相關併發症的風險。
內毒素可能透過被汙染的靜脈注射裝置或藥物進入血管,造成使用者發燒、發炎及內毒素血症等;不施予治療的情況下,則可能引發敗血症,進一步導致敗血性休克。為照護脆弱患者,包含年長者、重症治療患者及嬰兒,確保設備與藥物不被內毒素汙染極其重要;以嬰兒猝死症為例,此類重症案例已確診與血液中檢出之內毒素含量相關。
現行內毒素檢測方法介紹
本文描述並比較現行用於檢測細菌內毒素的分析方法。現行檢測方法包含美國藥典[USP40 <151>]以及歐洲藥典[Ph.Eur. 9.0 2.6.8]所述之家兔熱原試驗,其方法主要以產品注射於家兔,並於指定時限內持續監測注射兔之體溫變化;另外,單核球活化試驗以及使用鱟血球變形細胞裂解液(簡稱鱟試劑)的體外試驗亦被用於細菌內毒素檢測,其中又以鱟試劑最為廣泛使用。
鱟試劑主要活性來自其血球變形細胞裂解後的細胞液,目前製造鱟試劑的鱟來源為東方鱟(中國東南沿海)及美洲鱟(大西洋),根據美國藥典[USP40 <85>]載明來自東方鱟(Tachypleus Amoebocyte Lysate, 以下簡稱TAL)或美洲鱟(Limulus Amoeboyte Lysate, 以下簡稱LAL)的鱟試劑皆為合規之檢驗試劑。目前以此方法學原理共發展出三種檢測方法,分別為凝膠法、比濁法與比色法。
凝膠法
凝膠法是TAL/LAL試劑被用來檢測待檢品中是否含有內毒素的最簡單方法。當內毒素遇到TAL/LAL時,會啟動一系列酵素(酶)反應,此活化的反應途徑產生至少三種絲氨酸蛋白酶酶原,依次為C因子、B因子與凝固酶原。這些酶的連續作用促使TAL/LAL試劑中本為可溶性的凝固原蛋白轉變成可被檢測的凝膠塊。
根據美國藥典[USP40<85>]所述,使用TAL/LAL試劑進行內毒素檢測時,應確實遵循試劑製造商發佈的產品說明,正確地使用試劑及執行檢測。內毒素檢測通常選用10x75 mm去熱原玻璃試管做為反應容器,簡述過程如下。
-
按照試劑製造商的建議加入適量的無熱原水於TAL/LAL試劑瓶,輕輕搖晃使充分溶解後成為TAL/LAL重組裂解液。
-
按待檢品性質製備為待檢溶液。
-
在玻璃試管中加入等量的重組裂解液與待檢溶液,輕搖使混合均勻。
接著將此反應混合液放入預熱至37±1ºC的乾浴或水浴槽中,使試管處於無干擾的狀態直至TAL/LAL試劑製造商已完成確效所建議的作用時間結束。
比濁法
比濁法為測量反應混合液達到預定吸光值/透光率所需時間或反應混合液的濁度變化速率。比濁法源自凝膠法,除了自動化之外,改良後的TAL/LAL試劑使用較低量的凝固原蛋白,因此反應混合液不會形成固體凝塊,而是以濁度變化呈現反應混合液中的內毒素含量。
比濁法相較於凝膠法,其優勢在於提供定量結果。以下簡述比濁法檢測內毒素的步驟。
-
以微量孔盤進行二重複的試驗設計。
-
在微量孔盤中加入等量的重組裂解液與待檢溶液;
-
將含有反應混合液的微量孔盤放入預熱至37±1ºC的恆溫光度計中;
-
隨著反應時間遞移,光度計自動監測反應混合液在特定波長之濁度變化,並記錄到達預定吸光度之時間。
反應混合液的反應時間(到達預定吸光度所需時間)與內毒素含量成反比,對照標準曲線各濃度點的反應時間,可計算出反應混合液中存在的內毒素含量。
比濁法同樣以陽性對照組進行待檢品干擾因子測試,並由此得知待檢品最佳稀釋倍數,在此條件下,干擾因子對內毒素檢測的正確性不具影響。相較於凝膠法的陽性對照組僅具備定性對照功能,在比濁法則具體提供外加內毒素的回收率。美國藥典[USP40<85>]明訂此回收率範圍為50%-200%,可作為據以判定該次內毒素檢測試驗是否有效的條件之一。
比濁法對來自懸浮或混濁產品的干擾特別敏感,這些性質可能造成偽陽性結果,例如測試血液、血漿、血清或類似物質的結果可能會有所不同。
比色法
比色法始於1977年,科學家發現鱟血球細胞裂解液可水解含有顯色團(對-硝基苯胺,以下簡稱pNA分子)的特定氨基酸序列,於是以人工合成顯色基質,該基質包含模擬凝固蛋白切割位的特定氨基酸序列和pNA分子,當內毒素活化TAL/LAL時,活化的酵素作用在這個人工合成的凝固原蛋白切割位,並釋出pNA分子,使最終反應溶液呈現獨特的黃色。
pNA分子僅吸收特定波長的光源,故比色法只測量此特定波長下的吸光度,且吸光度和待檢溶液中的內毒素含量成正比。以比色法檢測內毒素的步驟簡述如下:
-
以微量孔盤進行二重複的試驗設計。
-
在微量孔盤中加入等量的重組裂解液與待檢溶液;
-
將含有反應混合物的微量孔盤放入預熱至37±1ºC的恆溫光度計中;
-
隨著反應時間遞移,光度計自動監測並記錄特定波長的吸光度變化。
在試驗過程中,設定405nm的光度計持續測量釋出的pNA,依測得數據畫出反應時間與內毒素濃度關係的對數/對數圖,達到特定吸光度的反應時間與反應混合物中的內毒素含量係成反比。

比色法又分為動力比色法與終點比色法。在動力比色法中,對照標準曲線各濃度點反應時間,即可由反應混合液的反應時間計算出待檢品的內毒素濃度。終點比色法則僅在試驗起始及預定反應時間結束時讀取每個反應混合液的內毒素數值。進行待檢品之內毒素測試時,動力或終點比色法的標準曲線都必須包含至少3個已知內毒素濃度,圖示範例於下。
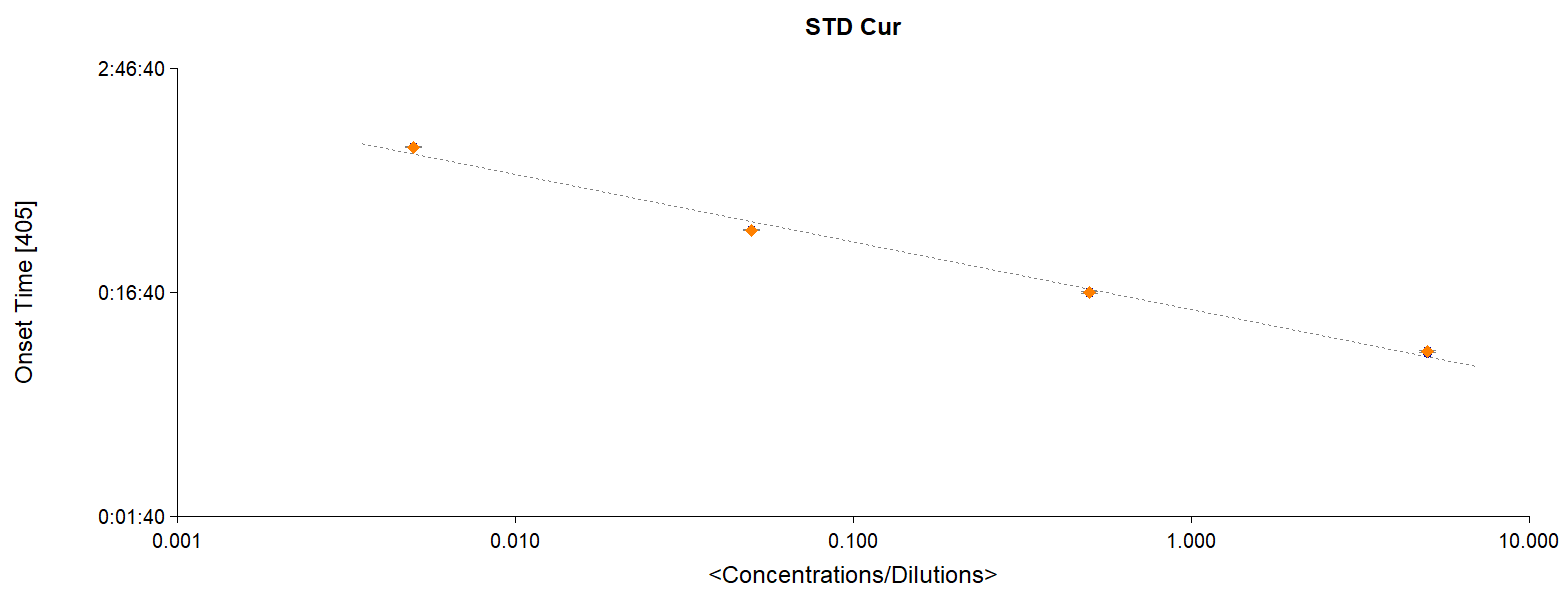
圖1:以動力比色法進行內毒素定量檢測之標準曲線圖
比色法方便操作,且容易進行計算,許多實驗室趨向使用比色法。但是測試的靈敏度伴隨著容易發生干擾的問題;干擾多來自待檢品本身,例如造成試劑中的蛋白質變性或與內毒素結合形成沉澱等。此外,有些待檢品遇到TAL/LAL時,會產生特定顏色干擾測試結果,例如特定絲氨酸蛋白酶在溶液中的顏色會造成偽陽性。
比色法與比濁法同具備以下優勢:
-
自動化的定量方法;
-
微量孔盤的試驗設計使操作人員能同時進行更多待檢品的內毒素測試;
-
透過變異係數(CV)得知測試的精確度。
檢測結果允收條件
現行的美國藥典[USP40 <85>]已與歐洲藥典及日本藥典調和,根據美國藥典[USP40 <85>]所載,檢測結果的允收應同時符合以下四項要求:
-
標準曲線上各個濃度點與反應時間的相關係數絕對值必須大於0.98;
-
標準曲線的零點(blank),其反應時間必須大於標準曲線的最低濃度點(偵測極限值);
-
標準曲線及待檢溶液的各個濃度點,其重複試樣間的反應時間偏差(%CV)必須符合裂解液製造商設定的CV值要求,例如TAL試劑製造商建議重複試樣間的反應時間偏差必須小於10%。
-
待檢溶液中外加定量內毒素之回收率必須介於50%-200%。
總結
本文所提及的測試方法於美國藥典[USP40 <85>]、歐洲藥典[Ph.Eur. 9.0 2.6.14]及日本藥典[XVII 4.01]皆被載明可用於醫療器材、針劑、及製造原料之內毒素檢測。一般來說,單次測試應使用來自單一製造商的內毒素試劑,亦即不同製造商的內毒素試劑不得在任何應用中混用。
相較於凝膠法,比濁法和比色法最顯著的優勢為可量化內毒素檢測結果,此優勢在原料檢測時尤其重要,因為這些數值可用來預測特定原料至終產品階段可能造成的內毒素污染。
比濁法和比色法都是適用於多數量待檢品且方便操作的方法,其中比色法更包含許多不同化合物的交互作用。因此,使用比濁法或比色法時,新批次試劑的有效靈敏度驗證以及干擾因子測試等預備試驗,為不可缺的過程。
上述方法各有優劣,在內毒素檢測發展至完全自動化前,因人為操作失誤或判讀偏差而導致結果失準的情形仍難以避免。因此,對執行內毒素檢測的技術人員實施妥善培訓有其必要性。不同的待檢品可能適用不同的檢測方法,技術人員的訓練應確保其在每種方法皆已受過良好訓練,且完全清楚個別方法的優勢和限制,以及不同待檢品可能遭遇的困難,在每一個步驟都小心謹慎。
內毒素檢測不僅是關鍵項目,同時也是實施品質管控不可或缺的重要工具。

儀器訓練課程:課程網路報名
| 03月11日 |
同步定量PCR之原理與實機操作(ABI QuantStudio 7
Flex Real-time PCR)
|
|
| 03月18日 | 生物能量代謝測定儀(Seahorse XF 24 Analyzer) | |
| 03月19日 |
螢冷光膠體影像分析系統介紹及實機操作 (UVP BioSpectrum 810 Imaging System) |
|
| 03月21日 |
第三代長片段核酸定序技術 (Third Generation Sequencing-Oxford Nanopore MinION) |
|
| 03月25日 | 電動倒立螢光顯微鏡實機操作 | |
| 03月27日 | 冷光膠體影像分析儀(GE LAS4000)實機示範 |
研究新知課程:課程網路報名
| 03月20日 |
Rhapsody單細胞多重基因分析系統
(New Frontiers in Single Cell Multi-Omics Data Analysis) |
|
| 03月20日 | 光纖感測技術(FOPPR)在臨床醫學與生物標記檢測之應用 | |
| 03月26日 | How to Combine Cell Culture and Cell-Based Assays with Imaging |
歡迎您訂閱共同研究室電子報以收取儀器訓練與研究新知課程講習相關資訊 。
為持續提供優質之研究服務,便於日後聘用專職技術人員、購置新儀器、現有儀器汰舊換新與維護保養等等,敬請於使用共同研究室資源並發表論文時,於論文致謝(Acknowledgement)處加入致謝共同研究室之文句,並於論文發表時通知共同研究室管理人員。致謝文句請依實際使用情形書寫,或請參考以下範例:We
thank the staff of the Core Labs, Department of Medical Research, National
Taiwan University Hospital for technical support.