
共 同 研 究 室 電 子 報
第145期 Jan.10.2026
本期目錄
下期主題
快速連結
隨著臨床與轉譯研究逐漸走向高維度與空間化分析,傳統免疫染色已難以全面回應複雜的研究需求。本期將介紹以金屬同位素與CyTOF 為基礎的Imaging Mass Cytometry (IMC) 空間蛋白體學技術,說明其如何突破螢光限制,並透過腎臟研究實例,展現高維度空間蛋白體分析在臨床研究中的應用潛力。下一期電子報主題為[微菌研究 × 轉譯醫學:從相關性走向因果驗證--微菌培養與功能驗證核心技術服務平台],敬請期待,並竭誠歡迎您訂閱共同研究室電子報以收取儀器介紹、研究新知、與每月訓練課程資訊,更歡迎您與我們聯絡,給予我們建議與鼓勵。
醫學研究部
蛋白質體核心團隊
新學社科技
許棠惠
產品經理
近年來,高維度免疫分析在醫學研究中的重要性日益提升。隨著研究問題愈加複雜,傳統以螢光訊號為基礎的多重免疫技術逐漸暴露出其物理上的侷限,包括光譜重疊、自體螢光干擾與補償矩陣等問題,使多重染色難以突破既有的標記上限,也增加弱表現蛋白的偵測難度。當研究者希望在同一實驗中同時觀察多個細胞族群、免疫調控蛋白或腫瘤微環境的複雜互動時,螢光平台的限制更顯突出。
在此背景下,金屬同位素為媒介的 CyTOF(Cytometry by Time-of-Flight) 提供了具突破性的解方。CyTOF 以 ICP-TOF 質譜技術分離金屬訊號,每一個標記皆以離散的質量峰呈現,完全跳脫光譜連續性所帶來的干擾 (圖一)。
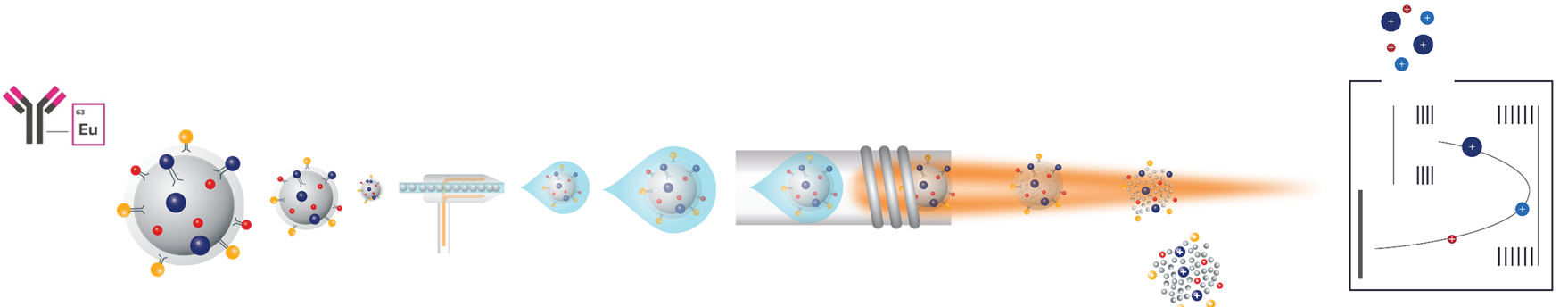
圖一、CyTOF 技術原理示意。 金屬同位素標記抗體經 ICP-TOF 質譜分離後,可在單次分析中同時偵測多重蛋白表現。
金屬同位素不存在於生物體背景中,因此沒有自體螢光問題;不同同位素之間具有明確質量差異,使訊號不需補償也能清楚區分。這些特性使 CyTOF 能在單次實驗中同時量測四十至五十種蛋白標記,並提供穩定且可量化的高維度資料。此外,金屬同位素標記抗體具備訊號乾淨、跨通道干擾極低的特性,使多重 panel 的設計更加彈性,不再受限於螢光組合的複雜規則 (圖二)。對臨床與轉譯研究而言,CyTOF 所帶來的高解析度資訊,有助於深入描繪免疫細胞的異質性、疾病相關細胞亞群的變化,以及微環境在不同病程中的動態調控。
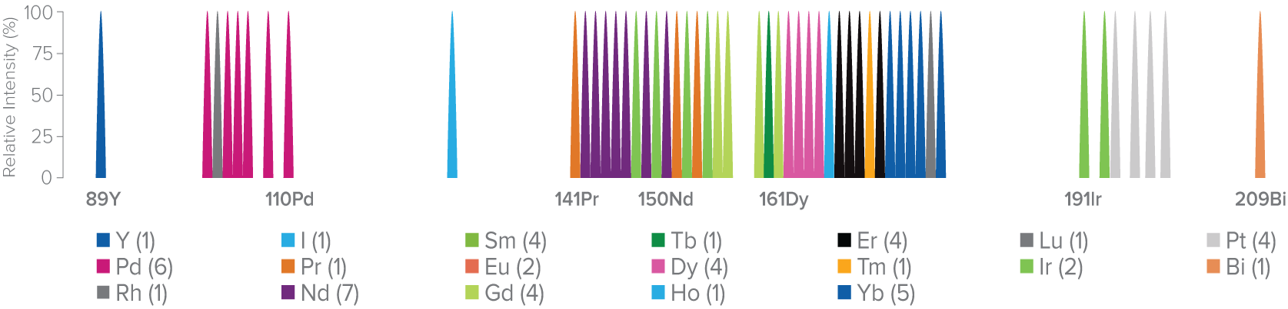
圖二、CyTOF 金屬通道示意圖。各金屬同位素標記抗體於質譜中分屬獨立通道,避免訊號干擾,支援高多重免疫分析。
值得留意的是,CyTOF 的應用並不僅限於懸浮細胞的單細胞分析。其金屬同位素的訊號特性亦能進一步被影像化,形成 Imaging Mass Cytometry(IMC)。IMC 可在 FFPE 或冷凍組織切片上進行多達四十種以上的金屬標記染色,並以 1 μm 的空間解析度描繪蛋白表現的分布 (圖三)。此特性使 IMC 同時具備傳統病理染色之組織結構判讀與高維多重免疫染色的蛋白表現與分布資訊,成為目前全球醫學中心逐步採用的空間蛋白組學技術。
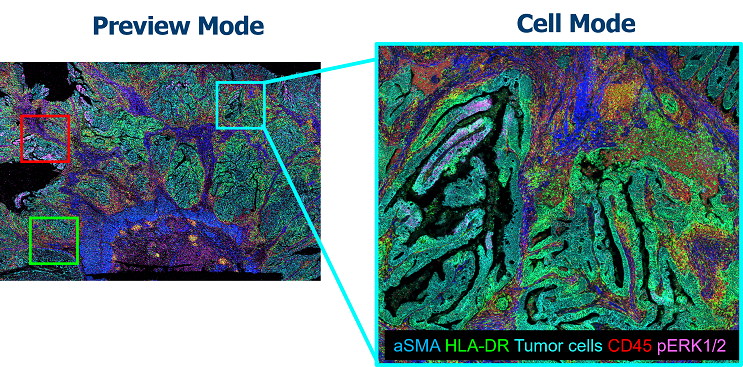
圖三、IMC 掃描模式示意。研究者可先於低倍預覽影像中選取 ROI,再以 1 µm 解析度進行高精度多重蛋白分析。
對臨床醫師而言,IMC 的重要性在於它能直接在單張切片上呈現多種細胞族群之間的距離、接觸關係與微環境分布,而不再需要依賴多次染色、多張切片或主觀推測來判斷細胞間的互動 (圖四)。
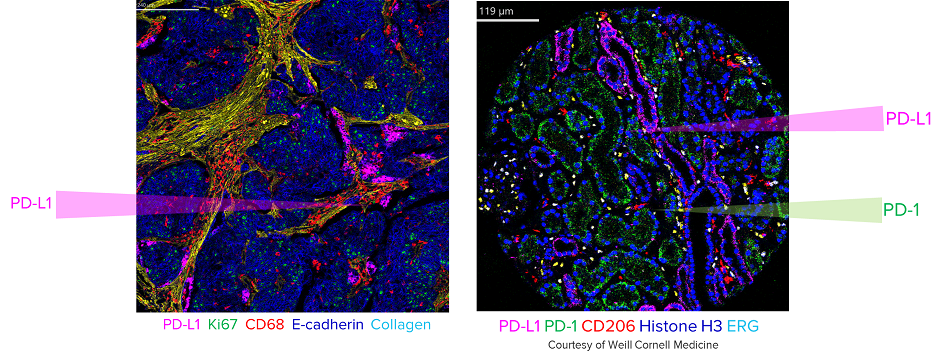
圖四、IMC 多重免疫影像。可同時觀察多種蛋白的表達程度及其在組織中的空間位置,協助解析腫瘤與免疫細胞的微環境結構。
腎臟疾病研究便是一個 IMC 發揮高度價值的典型例子。腎臟組織由多種細胞類型組成,包括曲小管細胞、集合管細胞、基質細胞、內皮細胞及多樣化的免疫細胞,其空間架構高度複雜且具區域性。傳統病理染色雖能呈現結構變化,但對免疫細胞的分類能力有限,也難以一次觀察大量蛋白的表現差異。近年的研究利用 IMC 在腎臟組織中進行多重免疫分析,清楚描繪不同腎臟結構區域的免疫細胞浸潤情形,並能同時觀察腎臟受損區域的細胞表型變化。例如,在分析腎功能減退與發炎相關的腎臟組織時,可利用 IMC 同時讀取近曲小管細胞、遠曲小管細胞、腎臟纖維母細胞與多種免疫細胞的空間分布。研究顯示,CD8 T 細胞與 CD68、CD163 陽性巨噬細胞的增多,常與腎臟受損區域的位置緊密相關,而這些空間共現訊號能為腎臟病變的機制提供關鍵證據。
IMC 在此類研究中的角色,不僅是鑑定細胞種類,更重要的是重新描繪細胞間的「空間互動關係」,協助醫師與研究者理解免疫細胞如何參與腎臟損傷的發生與惡化。在腎功能受損(impaired renal function, IRF)後,多項與發炎反應、免疫調控與細胞訊號傳遞相關的生物學路徑顯著上調。進一步分析人類腎臟組織切片,可觀察到隨血清 creatinine 上升,CD68⁺/CD163⁺ 巨噬細胞與 CD3⁺/CD8⁺ 細胞毒性 T 細胞在腎臟組織中的分布與密度明顯改變。腎小管結構則以 Aquaporin-1 與 Calbindin 作為近曲與遠曲小管的標記,以利解析免疫細胞與腎臟結構之間的空間關係 (圖五;上)。
進一步的 IMC 定量分析顯示,多種與腎絲球與近曲小管損傷及纖維化相關的細胞族群(如 vimentin⁺、nestin⁺、collagen⁺ 與 α-SMA⁺ 細胞)在 IRF 狀態下比例增加,顯示免疫細胞浸潤與腎臟結構重塑之間的密切關聯 (圖五;下)。此結果突顯 IMC 在同一張組織切片中,同步整合免疫細胞組成、腎臟結構變化與空間分布資訊的分析優勢。
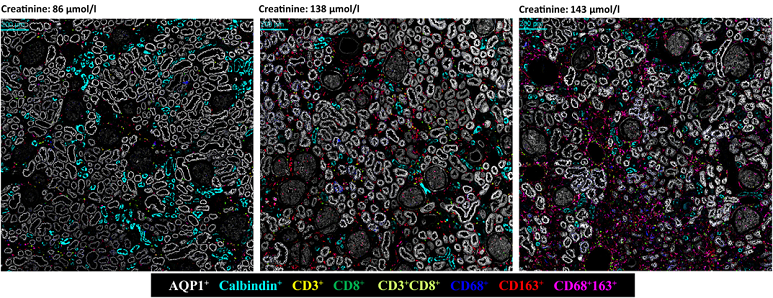
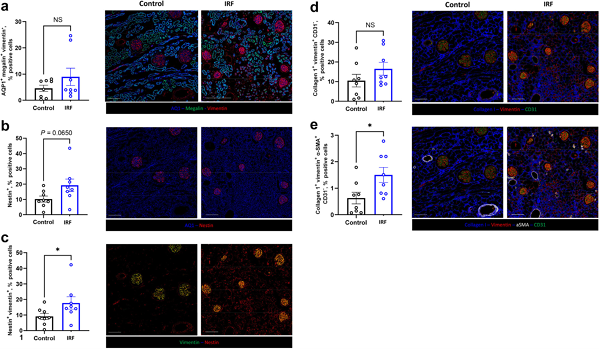
圖五、腎功能受損後腎臟免疫微環境的轉錄體與空間蛋白組學特徵。
在同一張組織切片上整合IMC與 MALDI-Mass Spectrometry Imaging(MALDI-MSI) 的新流程,可在單細胞且保留空間資訊的條件下,同時解析細胞表型與代謝物分布。研究團隊成功克服過去需使用連續切片、影像對位困難的限制,建立一套可將 MSI 偵測到的代謝物訊號,精準對應至 IMC 定義的單一細胞層級之分析策略。
此方法應用於三例人類結直腸癌(CRC)樣本,共鑑定 22 種細胞族群,並定量 112 種代謝物(以 glycerophospholipids 為主)。結果顯示,不同細胞類型(如癌細胞、基質/免疫細胞)具有明顯不同的脂質代謝特徵;其中 CD204⁺ 巨噬細胞展現獨特的 glycerophospholipid 組成,且即使在相同免疫細胞表型內部,仍可觀察到顯著的代謝異質性。這些發現支持「lipotype hypothesis」,指出細胞轉錄狀態與脂質組成之間具有雙向關聯。
新鮮冷凍組織切片首先進行 MALDI 基質塗佈並完成 MALDI-TOF-MSI,以取得代謝物在組織中的空間分布資訊。完成代謝體影像分析後,基質被移除並於同一張切片上進行金屬同位素標記抗體染色,隨後以 IMC 量測多重蛋白表現。經影像對齊、細胞分割與表型辨識後,可將代謝物訊號與免疫與結構蛋白表現整合至單細胞層級,建立代謝狀態與細胞表型之間的空間關聯 (圖六)。
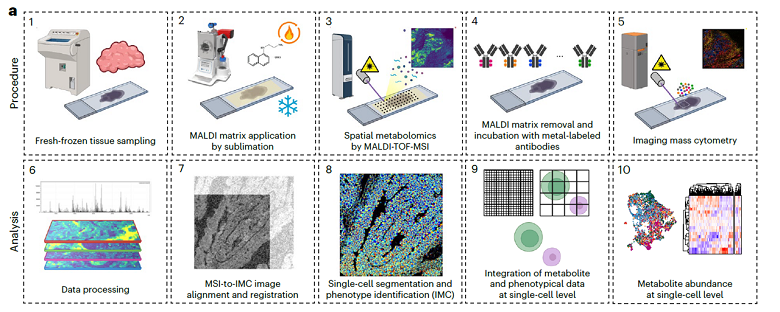
圖六、Imaging Mass Cytometry(IMC)與 MALDI-MSI 於同一組織切片上的序列式多體學分析流程。
從臨床的角度來看,CyTOF 與 IMC 的價值不僅是技術上的突破,更是臨床問題得以被更精確回答的工具。腎臟疾病、腫瘤免疫治療與慢性發炎性疾病等領域,正逐漸進入需要「高維度、低背景、高解析度」資料來支持推論的時代。醫師們所熟悉的病理判讀可透過 IMC 進入更精細的層次,而免疫治療反應、疾病進程與預後判斷也能在 CyTOF 的單細胞解析度中找到更具體的線索。
隨著高多重免疫分析在全球醫療體系中的發展,金屬同位素為媒介的 CyTOF-IMC 技術將逐漸成為連結組織、細胞與分子資訊的重要平台,也將成為臨床研究者在進行多重免疫分析時最值得納入考量的技術。
參考文獻:
-
Asowata, Evans O et al. (2024) Multi-omics and imaging mass cytometry characterization of human kidneys to identify pathways and phenotypes associated with impaired kidney function. Kidney international, 106(1), 85–97. DOI:10.1016/j.kint.2024.01.041.
-
Nunes, Joana B et al. (2024) Integration of mass cytometry and mass spectrometry imaging for spatially resolved single-cell metabolic profiling. Nature methods, 21(10), 1796–1800. DOI:10.1038/s41592-024-02392-6.
| 01月13日 | 肝癌微環境的單細胞與空間多組學整合研究 |
| 01月15日 | 高通量/海馬生物能量儀(Seahorse XF pro/XFe24 Analyzer)基礎儀器訓練課程 |
| 01月28日 | 解鎖外泌體臨床潛力:高效純化平台與整合分析經驗談 |
歡迎您訂閱共同研究室電子報以收取儀器訓練與研究新知課程講習相關資訊 。
為持續提供優質之研究服務,便於日後聘用專職技術人員、購置新儀器、現有儀器汰舊換新與維護保養等等,敬請於使用共同研究室資源並發表論文時,於論文致謝(Acknowledgement)處加入致謝共同研究室之文句,並於論文發表時通知共同研究室管理人員。致謝文句請依實際使用情形書寫,或請參考以下範例:We
thank the staff of the Core Labs, Department of
Medical Research, National
Taiwan University Hospital for
technical support.