 醫學研究部(Department
of Medical Research)
醫學研究部(Department
of Medical Research)共 同 研 究 室 電 子 報
第132期 Dec.10.2024
本期目錄
下期主題
快速連結
本期電子報探討細胞和基因療法(CGT)臨床前評估的重要性,強調在進入人體臨床試驗前,進行體外及體內試驗以證明療法的有效性與安全性。並且詳細討論了臨床前評估的關鍵考量,包括劑量、給藥途徑、目標人群及毒性監測等。歡迎有相關需求的同仁與我們聯繫。下一期電子報主題為[單細胞蛋白質體技術],敬請期待,並竭誠歡迎您訂閱共同研究室電子報以收取儀器介紹、研究新知、與每月訓練課程資訊,更歡迎您與我們聯絡,給予我們建議與鼓勵。
TOP
進階生物科技公司 曾湘文副總
隨著台灣再生醫療雙法(《再生醫療法》、《再生醫療製劑管理條例》)於2024年6月4日完成立法院三讀,未來針對基因、細胞及細胞產品之衍生物之產品,用以治療、修復或替換人體細胞、組織及器官的新技術與新製劑,將有更完整且明確的規範與管理。也代表著國內在細胞與基因療法上,將進入一個新的里程碑。因此了解與設計臨床前的功效與安全性評估試驗,是未來進入臨床試驗的重要依據。
細胞和基因療法 (Cell and Gene Therapy; CGT)臨床前評估的關鍵目標包含:透過體外(in vitro)和體內(in vivo)的模式,進行與建立概念驗證(Proof of Concept; POC)的關聯性,以證明該產品的療法是否具有臨床的效用。同時能夠提供人體首次臨床試驗(first-in-human clinical trials)合理性說明,提供科學依據以說明該研究對於患有特定疾病或狀況的受試者,進行首次人體臨床試驗的價值。由於是使用非人類的動物進行評估,因此考慮人類與不同物種間的特異性以及與疾病相關的差異就非常的重要。尤其在相關動物疾病模型的可用性,需有足夠的科學依據說明動物疾病模型與人類疾病的相關性,才能提高該產品的開發價值與成功上市的成功率。因此關鍵考量點包括:
-
預期未來在臨床使用的劑量和投藥途徑 (Route of administration; ROA)以及投藥間隔與頻率。
-
未來在臨床上使用的人群,特別是嬰兒、青少年和/或成年人,還是排除具生育能力的病患族群。
-
是否有具可供辨識潛在毒性或生理參數的參考標誌,以便作為臨床試驗時的監測依據。此外由於CGT產品的多樣性和各自獨特的產品生物特性,無法類似小分子藥物有較明確的國際指引或準則,因此在進行有效性與安全性的評估上必需使用靈活的測試策略(flexible testing strategy),無法採用一種標準方法(one size fits all)來執行,必須針對每個產品特性,採取合適的方式進行評估。美國FDA針對CGT的臨床前試驗,在2013年及發表Guidance for Industry (Preclinical Assessment of Investigational Cellular and Gene Therapy Products),說明法規單位的管理方向與態度,也是目前國際上針對CGT產品的重要指標。
細胞療法(cell therapy)的臨床前評估目標是希望透過合適的動物模式,以概念驗證(POC)的研究證明治療的效果證據,藉此展示在動物模型中,證明具有臨床疾病或醫療等相關特徵的治療效果。同時要能夠證實細胞命運(cell fate)的評估,說明這些細胞進入生物體後的持久性(persistence)、分布(distribution)、表現型(phenotype)和潛在的增殖能力(proliferation)。藉由與臨床相同的給藥途徑和體內微環境,同時說明這些細胞對於生物體的影響。藉此評估這些產品的實際功效性和安全性。此外必須評估在動物體內是否有潛在的致腫瘤性(tumorigenicity)風險,說明這些產品在動物體內與未來人體是否會導致腫瘤的形成。此外評估產品是否會引發免疫原性反應(immunogenicity)及宿主的整體反應(host responses)。
在基因療法(gene therapy)的臨床前評估上,除了與上述細胞療法包括劑量範圍確定、給藥途徑以及安全性等基本問題,還必須詳細描述這些基因產物是否可能嵌入到基因組中,包含載體(vector)的生物分佈性和持久性,以及是否有嵌入生殖系統細胞(germline transmission)的潛在風險,這是一個需要謹慎考量的重要安全問題。此外長期性的追蹤計劃必須根據基因療法產品的特性,制定適當的長期追蹤計劃,以監測其長期影響和潛在風險。此外需關注基因療法產品可能存在的脫落(shedding)問題,評估載體/病毒藉由分泌物或排泄物散播(dissemination),此現象應在臨床前的動物模式中探討與評估其風險。
在臨床前動物物種/模型的選擇與考慮上,由於國際上在動物福祉與3R的考量 上,目前選擇物種時,已不再要求必須多物種或靈長類做為必須的依據,而是根據研究需求來決定。必須選擇具有與人類相似生物學/藥理學相關的物種 (biologically/pharmacologically relevant species),以確保研究結果具有與未來臨床上的相關性。在某些情況下,如果沒有合適的活體模式來研究藥理作用,是可以使用體外模式的研究獲取相關的藥理學數據。由於跨物種間具有的免疫原性(immunogenicity),因此需使用免疫功能缺陷的動物模型(immunocompromised animal model)來進行研究。尤其在免疫正常的大型動物中,可能需要使用免疫抑制劑來排除免疫排斥得反應。目前常使用的免疫缺陷的動物模型,包含:裸鼠/裸大鼠、NSG/NCG/NOG/NPG/NOD-SCID小鼠、或是國內開發的ASID免疫缺陷小鼠。目前國際上也開發經過基因工程改造的人源化(轉基因)動物模型(humanized/transgenic animals),以模擬人類的免疫反應。但在執行GLP的安全性試驗時,穩定且具有完整實驗室歷史數據的動物品系,在法規單位的考量上就相當的重要。
在評估CGT產品安全性的試驗中,包含有生物分布(biodistribution)、致腫瘤性(tumorigenicity)、安全藥理(safety pharmacology)、以及一般系統毒性(general toxicity)等試驗,所有試驗的品質與過程均必須符合GLP精神與規範下進行。生物分布與致腫瘤性是CGT產品的獨特且重要考量,由於細胞產品在生物體內具有生長的可能性,也可能會分布到目標器官或組織之外的體內其他部位,因此評估進生物體內的細胞存活、增殖、分布、分化和持續性等關鍵性安全問題。目前透過非侵入性方式,可以隨著時間的推移在同一隻動物進行連續性評估,追蹤外來的細胞或相關衍生物(圖A)。例如透過放射性同位素標記或以螢光/冷光標記,作為連續性且長期性的評估方式。此外透過更敏感性的侵入性方式,例如qPCR/digital PCR 分析和生物體免疫組織化學染色法(immunohistochemistry; IHC)。例如目前常使用的標記為使用PCR評估human alu(圖B)或IHC評估Ku-80(圖C)等人類細胞的標誌。
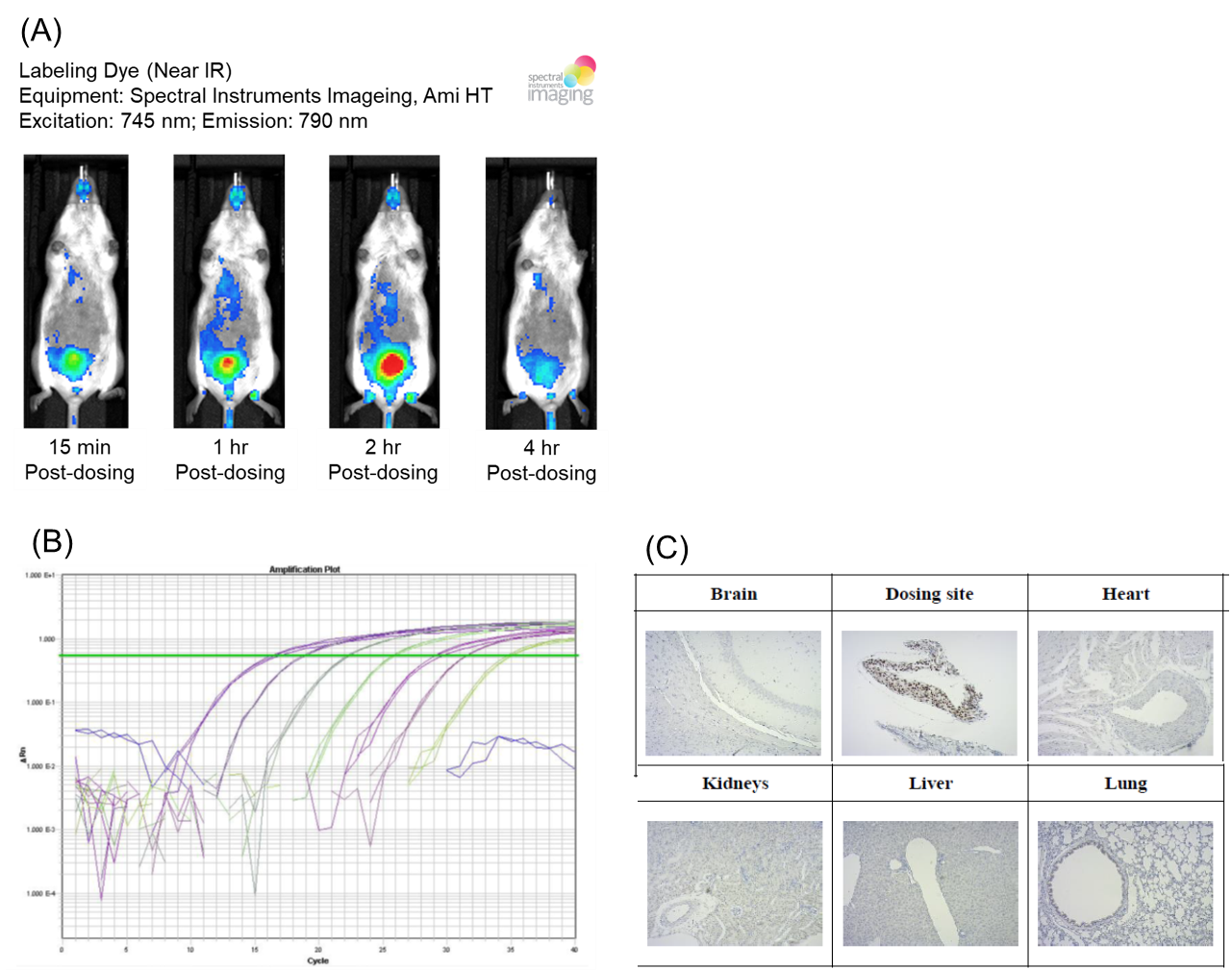
在致瘤性/致癌性(tummrigenicity/carcinogenicity)的評估上,也可以透過體外的軟瓊脂細胞群落形成試驗 (soft agar colony formation assay)。在活體模式上,可以使用免疫缺陷小鼠,評估致瘤潛力(tumorigenic potential)或異位組織形成(ectopic tissue formation)的風險。通常需要超過3個月到6個月的評估時間,監測腫瘤是否形成,並對所有動物體內腫瘤進行顯微病理學檢查。
通常透過齧齒類動物進行一般系統性的毒性評估,必須有足夠動物數量/組別,以確保整體研究的穩健性(robustness)。在不同的時間點和足夠的動物數量來評估急性和長期安全終點項目,已獲得未觀察到不良反應劑量 (No-Observed-Adverse-Effect-Level, NOAEL) 的確定。此外除細胞本身外,所有的終端產品(drug product)有關的試劑與容器,均必須根據 ISO 10993 評估生物相容性的風險。其中標準毒理學試驗終點,包含:死亡率、臨床觀察、體重、體重增加、食物消耗、局部耐受性、眼科檢查。在臨床病理學需評估血液學、凝血、血清化學、以及尿液分析。解剖時進行的肉眼觀察 (gross necropsy)評估 (大體觀察、器官重量[絕對、相對於腦重量、相對於最終體重])、顯微病理學/組織病理學(histopathology)。此外由於CGT產品的特點,針對免疫反應和致瘤性 (包含載體/轉基因[Vector/transgene]以及轉導/非轉導[transduced/nontransduced]細胞類型)。最後能夠完整的評估:(1)動物體內宿主免疫反應 (目標/非目標組織的發炎反應、自體抗體[autoantibody]、針對正常組織/器官的致敏細胞),(2)評估目標/非目標組織的功能和形態反應、(3)識別潛在的目標組織(target tissues),(4)最後包含評估毒性的特色,例如延遲毒性(delayed toxicity)與毒性的可逆性(reversibility of toxicity)。
由於CGT產品個別獨特性,因此在非臨床的評估上是具有相當大的彈性與討論性。因此美國FDA旗下的生物製劑評估研究中心(Center for Biologics Evaluation and Research; CBER)內設有治療產品辦公室(Office of Therapeutic Products; OTP),專門針對這類產品設有INTERACT meeting/Pre-IND meeting/IND meeting的輔導或諮詢服務。美國FDA自2023年3月15日起,要求所有送件的一般系統毒性的非臨床研究評估之原始數據,均必須使用非臨床資料交換標準(Standard for the Exchange of Nonclinical Data; SEND)格式進行送件。國內CDE也透過成立各項指標性案件的輔導計畫,希望與送件廠商或機構能夠事前先與相關的法規單位討論,以確認GLP實驗的設計,加快後續送審的時間。
由於CGT產品的多樣性和獨特性,因此在規劃產品的有效性與安全性的評估上,透過參考類似上市產的所公告出的試驗方式,是一個好的捷徑,以了解類似產品所進行的相關臨床前試驗的規模與類型。例如在歐盟與日本核准用來治療克隆氏症的Alofisel®、美國FDA於2023年核准治療第一型糖尿病患者的Lantidra®、以及對血癌患者使用的異體臍帶血幹細胞治療Omisirge®等。透過目前已成功上市的產品所提交的各項CMC、藥理學、毒理學以及臨床試驗設計等相關資料,已加快產品研發的進展。
儀器訓練及研究新知課程
| 12月18日 |
落地型超高速/高速離心機實機示範訓練課程 |
| 12月23日 | BD Lyric 流式細胞分析儀儀器教育課程 |
歡迎您訂閱共同研究室電子報以收取儀器訓練與研究新知課程講習相關資訊 。
為持續提供優質之研究服務,便於日後聘用專職技術人員、購置新儀器、現有儀器汰舊換新與維護保養等等,敬請於使用共同研究室資源並發表論文時,於論文致謝(Acknowledgement)處加入致謝共同研究室之文句,並於論文發表時通知共同研究室管理人員。致謝文句請依實際使用情形書寫,或請參考以下範例:We
thank the staff of the Core Labs, Department of
Medical Research, National
Taiwan University Hospital for
technical support.