 醫學研究部(Department
of Medical Research)
醫學研究部(Department
of Medical Research)共 同 研 究 室 電 子 報
第102期 JUN.10.2022
本期目錄
下期主題
快速連結
生物組織透明化技術,已在國際上被廣泛用於各式臨床與基礎研究的樣本,像是心臟、腎臟、皮膚、腦與骨骼等,以獲取高解析度3D生物影像。其相關研究成果已收錄於數百篇國際期刊中,例如Nature,Science與Cell等。生物組織透明化商品(例如:RapiClearTM 等)除了對樣本的細微形態結構不會造成傷害之外,各式標定的螢光蛋白與免疫螢光染劑等訊號在生物組織透明化過程中也可以被妥善的保護。在正確存放的情況下,樣本的螢光訊號可維持長時間,非常適合重要樣本的保存。下一期電子報主題為「醫學研究部小動物實驗核心簡介」,敬請期待,並竭誠歡迎您訂閱共同研究室電子報以收取儀器介紹、研究新知、與每月訓練課程資訊,更歡迎您與我們聯絡,給予我們建議與鼓勵。
共同研究室專為醫學校區研究人員提供動物操作實驗而新設立專責作業場所,本場所有二個區域,一在動物中心九樓914室
(已啟用),另一在八樓的第四手術室(近期即將啟用),由本部小動物實驗核心同仁專人服務。敬請期待,並給予我們建議和指導。
TOP
孫金生物科技公司 林志勇博士
前言
使用光學系統觀察生物組織時,常會面臨因為光散色(light scatter) 的問題所導致樣本深層影像模糊的困擾。長久以來,科學家採用連續薄切片(5-20 µm) 配合顯微鏡取像及3D重建等技術,以獲取樣本內部的三維生物資訊。但缺點是重建過程不僅耗時費力,且常發生因切片造成樣品破壞而導致的影像對位(alignment)不易與資訊不連續或遺漏等問題。 近十年,透過各式透明技術(optical tissue clearing)的使用,已可大幅改善樣本內的光散色干擾,同時保留樣本內的細微形態結構。因此可藉由配合如共軛焦顯微鏡(confocal microscopy), 層光螢光顯微鏡(light sheet fluorescent microscopy)與螢光標定技術等,連續性取得數百微米(µm)至數十毫米(mm)樣本厚度的3D影像。其應用範圍更已從實驗動物延伸至臨床檢體。 本文以簡潔的方式概述不同透明技術的發展現況,提供對生物3D影像有興趣的初學者一些基礎知識。
組織透明Tissue transparency
當光波通過具有非均勻折射率(nonhomogeneous
refractive index)物質的生物組織時,折射率的差異會導致光波在不同物質界面處產生折射(refraction),從而使波前的形狀出現失真,也就是光散色的現象。所以,如果可以將組織內部不同構成物質的折射率趨近一致化,即可將組織呈現出透明的效果(Richardson
and Lichtman,2015)。Werner
Spalteholz是首位成功將組織透明化的科學家,藉由使用Methyl
salicylate/ Benzyl benzoate (5:3 vol:vol),改善人體心臟與骨骼等樣品的光散色干擾(Spalteholz,1914),可惜受限於當時的光學技術,Spalteholz的方法並未被廣泛使用。
直到1980年代末期,才有科學家將Spalteholz
方法中的methyl
salicylate
以benzyl
alcohol取代,進一步發展出Murray’s
clear (BABB)
技術(Dent
et al.,1989)。近年來,,受惠於光學系統與細胞螢光標定技術的不斷演進,多項透明化技術的應用也陸續發表。依使用方式不同,可大致分為2類方法,分別是以有機溶劑為基礎
(solvent-based clearing)
及以水溶液為基礎
(aqueous-based clearing) (圖一)
。
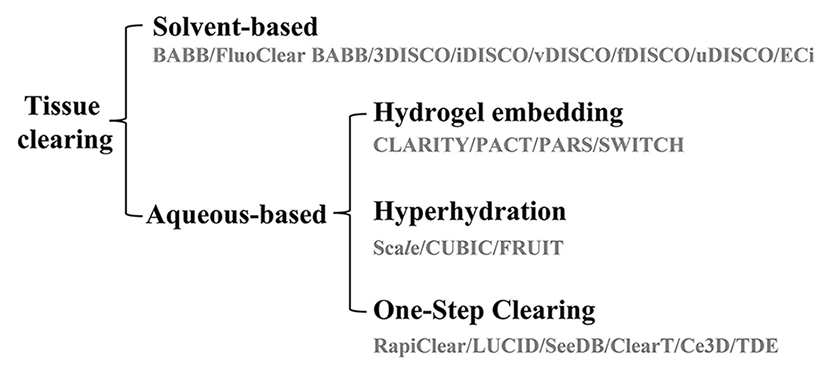
圖一、透明化技術的種類。依使用方式可分為有機溶劑類(solvent-based clearing) 及水溶液類(aqueous-based techniques) 。水溶液類又可再區分為3類型: 水凝膠型(Hydrogel embedding) ,超水合型(Hyperhydration) ,簡易型(one-step clearing) 。
有機溶劑透明化技術 Solvent-based clearing
有機溶劑透明化過程中,固定化(fixation)樣品會先經過methanol或tetra-hydrofurane脫水(dehydration)處理,再置入高折射溶劑,例如methylsalicilate,,benzyl
alcohol,benzyl
benzoate,dichloromethane,與
dibenzyl ether中浸泡。常見的方法以BABB
及DISCO系列為主(Renier
et
al.,2014)。這類方法的優點在於實驗操作容易、快速以及透明化效果絕佳,適用於全器官或整隻實驗鼠透明化實驗。但須注意溶劑毒性與腐蝕性、樣品形變與體積萎縮、螢光蛋白訊號淬滅(quenching)、自發性螢光背景值(autofluorescence
background)上升等不良影響。
水溶液透明化技術 Aqueous-based clearing
多數水溶液方法可避免上述有機溶劑對實驗者或樣品帶來的不良影響。常見的水溶液技術可分為3類型: 水凝膠型 (Hydrogel embedding)、超水合型(Hyperhydration) 、簡易型 (one-step clearing) 。
水凝膠透明化技術 Hydrogel embedding
此類型技術以2013年史丹佛大學Diesseroth教授發明的CLARITY technique為主要代表(Chung et al.,2013)。樣品先透過多聚甲醛(Paraformaldehyde)、丙烯醯胺(Acrylamide)及蛋白質三者鍵結形成高分子水膠(hydrogel) ,再經十二烷基硫酸鈉(sodium dodecyl sulfate,sodium salt, SDS) 處理移除細胞膜脂質,最後改浸泡於高折射率水溶液,例如:RapiClear CS或RapiClear 1.47試劑中達到樣本透明的效果 (圖二) 。
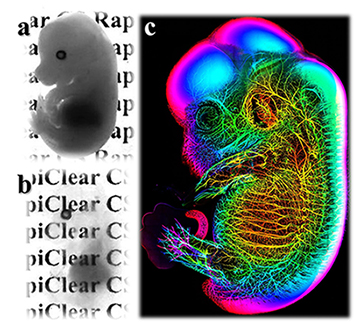
圖二、透明小鼠胚胎的影像。a ,胚胎於CLARITY處理之前。b , CLARITY處理之後並浸漬於RapiClear1.47中達到全胚胎透明化。c,經由抗體免疫染色後,3D化呈現胚胎內的神經網路影像。
絕佳的透明化效果、可重複多次進行抗體標定、保存螢光蛋白訊號及樣品不變形等是這類方法的優點,可適用於全器官或整隻實驗鼠透明化實驗。但須注意此實驗過程複雜,不建議初學者自學進行。
超水合型透明化技術 Hyperhydration
運用高濃度的尿素(Urea)與非離子型介面活性劑(Triton X-100)對樣品進行變性(denature)與去脂化(delipidation)處理,進而增加樣品的含水性(hydration)而降低樣品的整體折射率是這類型技術的特色。以Scale 與CUBIC 為主要代表。操作簡便、不錯的透明化效果以及可保存螢光蛋白訊號等,是這類方法的優點。適用於全器官或整隻實驗鼠透明化實驗。但須注意不能進行細胞膜染色實驗、樣品的體積會增加大約30%~50%、蛋白質有24%~41%遺漏的風險以及須3~4週的實驗進行時間等,是使用此方法的困擾(Richardson and Lichtman,2015)。
簡易型透明化技術 One-step clearing
只需進行短暫的通透性處理(permeabilization),之後樣品即可直接浸泡於高折射率的水溶液內進行透明化,省去繁瑣的水膠化或去脂化等處理步驟是這類型技術的特色(圖三)。
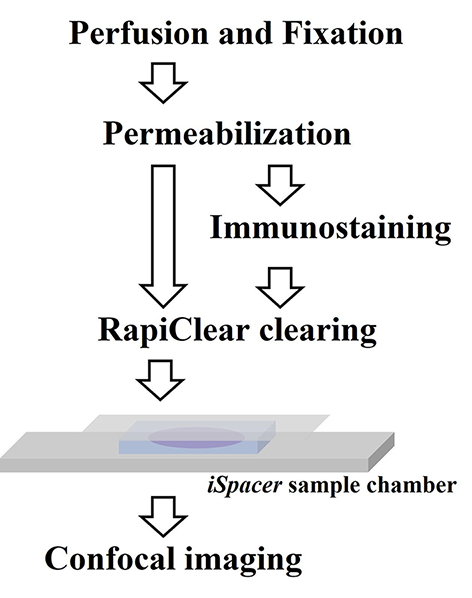
圖三、簡易型透明化技術的操作流程示範。
SeeDB(Ke et al.,2013)、ClearT(Kuwajima et al.,2013)及RapiClear1.52(Gomariz et al.2018)等方法為主要代表。雖然此方法的透明化效果最多只達到數百微米(µm)至數毫米(mm) 樣品深度,但其操作流程安全、簡便、快速、可妥善保存螢光蛋白訊號、樣品不變形、可進行細胞膜染色實驗與抗體螢光標定等眾多優點,依然吸引許多科學家使用(圖四)。

圖四、簡易型透明化技術可應用於不同小鼠組織。a ,鼠腦海馬迴的神經網絡圖。b 與c,小鼠淋巴結與其後腳掌的血管分布圖。
脫色 Decolorization
組織內常見色素(pigments) 的存在,例如血紅蛋白(hemoglobin),黑色素(melanin)和脂褐素(lipofuscin)因具有吸光與自發性螢光的特性,所以常會降低透明化樣本的螢光訊號品質 。可嘗試使用過氧化物(peroxides)、酸性丙酮(acid acetones) 、強鹼基(strong bases) 或Quadrol搭配銨溶液(ammonium solutions)等物質降低色素的干擾(Richardson and Lichtman,2015)。但須注意過氧化物等藥劑可能會對樣品型態與螢光蛋白訊號造成破壞。
取像Imaging
因透明化樣本厚度往往介於數百微米(µm)至數十毫米(mm),取像時須慎選適合樣本厚度的長工作距離(long working distance)鏡頭,以確保符合期望的取像深度。其次,因多數透明化樣本浸泡於1.38~1.56高折射率的溶液內,為了提升Z軸取像解析度以及避免產生嚴重PSF (point spread function)干擾,可優先考慮高折射率浸漬型鏡頭取像,例如油鏡、甘油鏡、矽油鏡等。再者,因透明化樣本體積大,所以取像消耗的時間可能長達數小時到數天。建議如需擷取高倍率與高解析度影像,可使用有搭配resonant scanner或spinning disk等附件快速取像型共軛焦顯微鏡以節省取像時間並減低樣本光褪色(photobleaching)傷害,例如Nikon AX-R、Leica SP8、Andor Dragonfly等。如果是完整器官或整隻實驗動物取像,建議改採層光螢光顯微鏡系統(light sheet fluorescent microscopy) ,例如Zeiss Lightsheet 7或Bruker LCS-SPIM。但須注意此類型層光顯微鏡取像系統 (detection optics)大都使用低倍率與低解析度鏡頭,例如5倍/NA0.16。
資料處理Data handling
最後一步,也許是最重要的步驟是3D影像呈現以及資料分析和解釋。因為透明化樣本產生的影像庫資料將可能達到上百TB (terabytes),如何進行妥善的資料傳輸、儲存、分析等是一項十分令人困擾的議題(Richardson and Lichtman,2015)。 建議擷取影像後可先進行影像壓縮以節省傳輸與儲存的時間與空間。Photoshop與 Fiji等軟體,都有搭配影像縫合 (Stitching)功能,可進行大影像拼接工作。Imaris 與 Vision4D等商業軟體雖然價格昂貴,但可以提供最佳的3D影像呈現及資料運算與分析的功能。
結語
毫無疑問,透明化技術將會持續的進步。也將有越來越多的方法,為改善目前厚樣品染色不易、取像耗時、分析困難等問題提供對策。透明化技術的下一個重要階段,可能是連結體學分析(omics analysis) ,例如轉錄組學(transcriptomics)、 代謝物組學(metabolomics)、或蛋白質體學( proteomics)等,進而對完整樣本於結構與功能上進行客觀分析。所以,諸如疾病進展監測、測試治療方案、藥物開發等都可受益於透明化技術的應用。
參考文獻:
-
Chung, K., Wallace, J., Kim, S.Y., Kalyanasundaram, S., Andalman, A.S., Davidson, T.J., Mirzabekov, J.J., Zalocusky, K.A., Mattis, J., Denisin, A.K., et al. (2013). Structural and molecular interrogation of intact biological systems. Nature 497, 332-337.
-
Dent, J.A., Polson, A.G., and Klymkowsky, M.W. (1989). A whole-mount immunocytochemical analysis of the expression of the intermediate filament protein vimentin in Xenopus. Development 105, 61-74.
-
Gomariz, A., Helbling, P.M., Isringhausen, S., Suessbier, U., Becker, A., Boss, A., Nagasawa, T., Paul, G., Goksel, O., Szekely, G., et al. (2018). Quantitative spatial analysis of haematopoiesis-regulating stromal cells in the bone marrow microenvironment by 3D microscopy. Nat Commun 9, 2532.
-
Ke, M.T., Fujimoto, S., and Imai, T. (2013). SeeDB: a simple and morphology-preserving optical clearing agent for neuronal circuit reconstruction. Nat Neurosci 16, 1154-1161.
-
Kuwajima, T., Sitko, A.A., Bhansali, P., Jurgens, C., Guido, W., and Mason, C. (2013). ClearT: a detergent- and solvent-free clearing method for neuronal and non-neuronal tissue. Development 140, 1364-1368.
-
Renier, N., Wu, Z., Simon, D.J., Yang, J., Ariel, P., and Tessier-Lavigne, M. (2014). iDISCO: a simple, rapid method to immunolabel large tissue samples for volume imaging. Cell 159, 896-910.
-
Richardson, D.S., and Lichtman, J.W. (2015). Clarifying Tissue Clearing. Cell 162, 246-257.
-
Spalteholz, W. (1914). Über das Durchsichtigmachen von menschlichen und tierischen Präparaten und seine theoretischenBedingungen, nebst Anhang: Über Knochenfärbung.
研究新知演講課程:課程網路報名
|
06月21日 |
利用人類誘導多功能幹細胞探討大麻對心血管之影響 |
|
06月27日 |
Investigating the coping function of the midbrain |
貴重儀器訓練課程:課程網路報名
|
07月01日 |
FACSLyric多色流式細胞分析技術的操作與應用 |
歡迎您訂閱共同研究室電子報以收取儀器訓練與研究新知課程講習相關資訊 。
為持續提供優質之研究服務,便於日後聘用專職技術人員、購置新儀器、現有儀器汰舊換新與維護保養等等,敬請於使用共同研究室資源並發表論文時,於論文致謝(Acknowledgement)處加入致謝共同研究室之文句,並於論文發表時通知共同研究室管理人員。致謝文句請依實際使用情形書寫,或請參考以下範例:We
thank the staff of the Core Labs, Department of
Medical Research, National
Taiwan University Hospital for
technical support.